Top 10 Phản ứng hóa học xảy ra hàng ngày mà có thể bạn không biết
Mọi thứ xung quanh chúng ta luôn không ngừng biến đổi. Các vật chất cũ tương tác với nhau, hình thành nên vật chất mới, đó gọi là phản ứng hóa học. Những gì ... xem thêm...chúng ta đang làm hàng ngày như đơn giản chỉ là bật mồi lửa châm điếu thuốc cũng do tác động của phản ứng hóa học. Và sau đây, Toplist sẽ trích ra những phản ứng quen thuộc nhất trong cuộc sống đời thường của chúng ta.
-
Quang hợp
Quang hợp là một trong những phản ứng hóa học phổ biến xảy ra hàng ngày và đóng vai trò rất quan trọng trong đời sống con người, động thực vật. Nói về quang hợp có thể coi là quá trình thu nhận năng lượng ánh sáng mặt trời của thực vật tảo và một số vi khuẩn để tạo ra hợp chất hữu cơ phục vụ bản thân cũng như làm nguồn thức ăn cho hầu hết các sinh vật trên trái đất. Năng lượng hóa học này được lưu trữ trong các phân tử carbohydrate như đường, và được tổng hợp từ carbon dioxide và nước.
Hầu hết các thực vật, tảo và vi khuẩn thực hiện quang hợp. Quang hợp giúp duy trì nồng độ oxy trong không khí và cung cấp tất cả các hợp chất hữu cơ và hầu hết các năng lượng cần thiết cho sự sống trên trái đất.Toàn bộ sự sống trên hành tinh chúng ta đều phụ thuộc vào quang hợp bởi vì sản phẩm quang hợp là nguồn chất hữu cơ làm thức ăn cho mọi sinh vật, là nguyên liệu cho công nghiệp và thuốc chữa bệnh cho con người. Quang hợp cũng là quá trình cung cấp năng lượng để duy trì hoạt động sống của sinh giới. Đặc biệt khi thực vật quang hợp, chúng sẽ biến đổi nước và CO2 (cacbon đioxit) hấp thụ được thành chất dinh dưỡng và khí oxi. Mà khí oxi lại chính là sự sống của con người, động vật, nên đó chính là lý do mà việc trồng cây xanh phải được thực hiện ở hầu hết các nơi, nhất là các nơi đông dân cư. Quang hợp giúp điều hòa không khí giải phóng oxi và hấp thụ CO2 (góp phần ngăn chặn hiệu ứng nhà kính; biến đổi khí hậu.
Phương trình tổng quát của quang hợp:
6 CO2 + 12 H2O →→ C6H12O6 + 6 O2 + 6 H2O
(as MT, dliệp lục)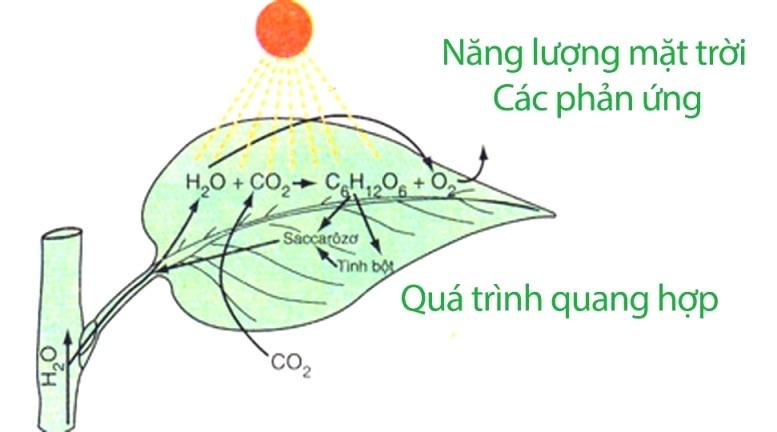
Quang hợp 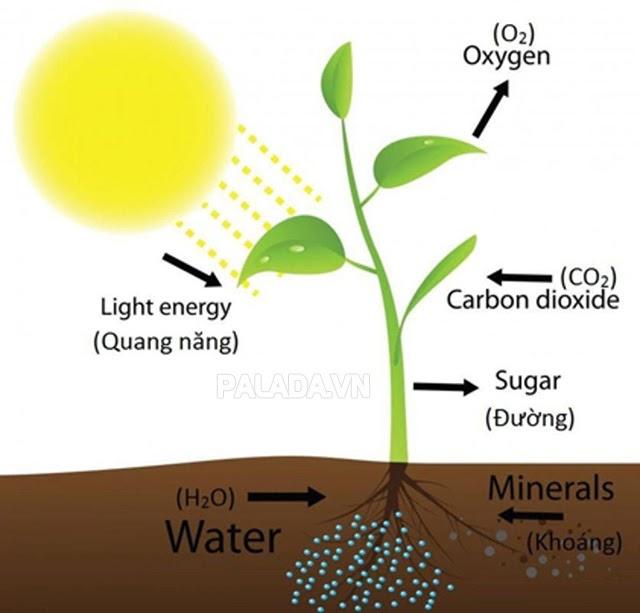
Quang hợp
-
Hô hấp hiếu khí
Hô hấp hiếu khí là quá trình xảy ra trong môi trường có O2, hô hấp hiếu khí chỉ thực hiện được khi có sự tham gia của O2 trong hô hấp. Hô hấp hiếu khí cùng với hô hấp kị khí, là một phần thuộc hô hấp ở xây xanh.
Hô hấp hiếu khí là quá trình phân giải nguyên liệu để sinh năng lượng cung cấp cho hoạt động sống của cơ thể. Nguyên liệu chúng sử dụng là đường đơn, trải qua giai đoạn đường phân và cho ra sản phẩm cuối cùng là ATP. Đặc điểm lớn nhất của hô hấp hiếu khí là nó cần môi trường có O2 để thực hiện quá trình hô hấp.Hô hấp hiếu khí có ý nghĩa rất đặc biệt, nó giúp tổng hợp ATP và cung cấp nguyên liệu cần thiết cho các phản ứng tổng hợp. Hệ số hô hấp là tỉ số giữa số phân tử CO2 thải ra và số phân tử O2 lấy vào khi hô hấp. Hệ số này cho biết số nguyên liệu đang hô hấp là nhóm chất gì và qua đó có thể đánh giá tình trạng hô hấp của cây.
Phương trình hóa học:
C6H12O6 + 6O2 → 6CO2 + 6H2O + Năng lượng (36ATPs).

Hô hấp hiếu khí 
Hô hấp hiếu khí -
Hô hấp kị khí
Hô hấp kị khí hay còn gọi là hô hấp yếm khí là quá trình phân giải cacbonhidrat để thu năng lượng cho tế bào, chấp nhận electron cuối cùng của chuỗi truyền electron là một phân tử vô cơ không phải là oxi phân tử. Ví dụ chất nhận electron cuối cùng là NO3 trong hô hấp nitrat, SO4 trong hô hấp sunphat.
Những chất nhận electron cuối này có khả năng khử kém hơn O2, có nghĩa là có năng lượng được sản sinh ra trên mỗi phân tử bị ôxi hóa ít hơn. Vì vậy, ta có thể nói rằng, hô hấp yếm khí kém hiệu quả hơn hô hấp hiếu khí.
Nguyên liệu được sử dụng trong hô hấp kị khí là đường đơn, trải qua quá trình đường phân và cho ra sản phẩm cuối cùng là ATP. Quá trình này xảy ra ở môi trường không có O2 tại màng sinh chất của sinh vật nhân thực (Không có bào quan ty thể). Hô hấp yếm khí được sử dụng chủ yếu bởi các vi khuẩn và cổ khuẩn sống trong môi trường thiếu thốn ôxi. Nhiều sinh vật yếm khí thuộc trong dạng yếm khí bắt buộc, tức là chúng sẽ chỉ hô hấp được với những hợp chất yếm khí và sẽ chết nếu có sự hiện diện của ôxi.Hô hấp yếm khí là một thành phần quan trọng của chu trình nitơ, sắt, lưu huỳnh và carbon toàn cầu thông qua việc giảm các oxy hóa của nitơ, lưu huỳnh và carbon thành các hợp chất khử nhiều hơn. Chu trình hóa sinh của các hợp chất này, phụ thuộc vào quá trình hô hấp yếm khí, tác động đáng kể đến chu trình carbon và sự nóng lên toàn cầu.
Hô hấp yếm khí xảy ra trong nhiều môi trường, bao gồm trầm tích nước ngọt và biển, đất, tầng ngậm nước ngầm, môi trường dưới bề mặt sâu và màng sinh học. Ngay cả môi trường, chẳng hạn như đất, có chứa oxy cũng có môi trường vi mô thiếu oxy do đặc tính khuếch tán chậm của khí oxy.
Một ví dụ về tầm quan trọng sinh thái của hô hấp yếm khí là việc sử dụng nitrat làm chất nhận điện tử cuối, hoặc khử nitrat hòa tan, là con đường chính mà nitơ cố định được đưa trở lại khí quyển dưới dạng khí nitơ phân tử. Một ví dụ khác là methanogenesis, một dạng hô hấp carbonate, được sử dụng để sản xuất khí metan bằng cách tiêu hóa yếm khí. Mêtan sinh học được sử dụng như là một thay thế bền vững cho nhiên liệu hóa thạch.Phương trình hóa học:
C6H12O6 → 2C2H5OH + 2CO2+ năng lượng.

Hô hấp kị khí 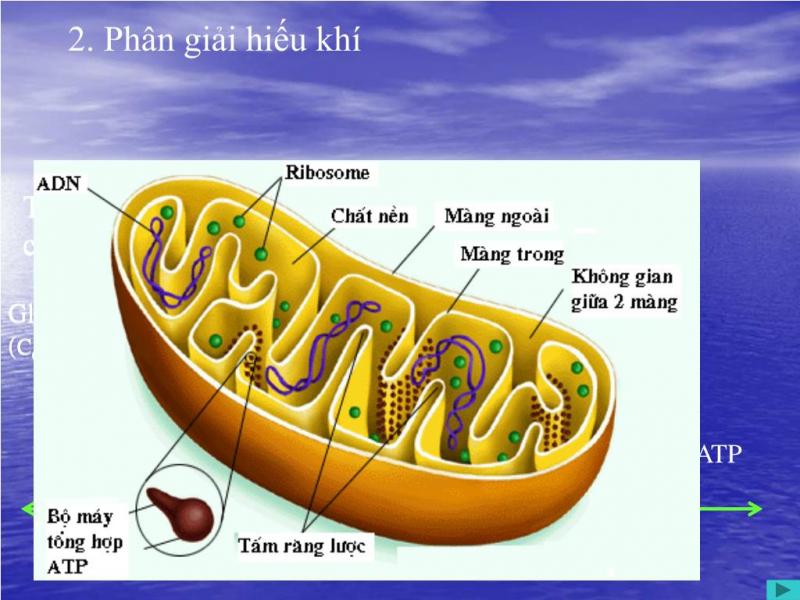
Hô hấp kị khí -
Sự cháy
Một cách đơn giản, sự cháy là phản ứng giữa 1 chất với oxy tạo nên ngọn lửa. Ngọn lửa quen thuộc nhất đối với chúng ta có trong bếp (khi đun nấu bằng gaz, bằng than, bằng dầu hỏa), trong phòng khách lãng mạn với ngọn nến, hay khi ai đó châm điếu thuốc bằng diêm hay bật lửa. Nhắc đến cháy là phản ứng oxy hóa – khử nhiệt độ cao giữa chất đốt và chất oxy hóa, thường là oxy khí quyển, tạo ra các sản phẩm oxy hóa thường dạng hơi, trong một hỗn hợp gọi là khói. Sự cháy tạo ra ngọn lửa, và tạo ra nhiệt độ đủ cho sự cháy tự duy trì. Phần lớn mọi thứ đều cháy được, thế nên việc phòng cháy chữa cháy là hết sức quan trọng.
Sự cháy có thể nhận ra bởi mùi khét: cháy điện, cao su, sợi bông,…mùi thơm: mật, đường, mùi khí sốc: SO2, SO3, Clo. Bên cạnh đó sự cháy luôn đi kèm với khói. Khói là sản phẩm của sự cháy, sinh ra từ các chất cháy, chất cháy khác nhau sẽ có màu sắc khác nhau, màu sắc của khói phụ thuộc vào điều kiện cháy đủ không khí hoặc thiếu không khí. Ngoài ra sự cháy có một đặc trưng gồm ánh lửa và tiếng nổ.
Ví dụ phản ứng cháy của propan, hình thành trong vỉ nướng ga và một số lò sưởi:
C3H8 + 5O2 → 4H2O + 3CO2 + năng lượng.

Sự cháy 
Sự cháy -
Gỉ sét
Theo thời gian, bề mặt phía ngoài các thanh sắt phát triển một lớp phủ màu đỏ, dễ bong gọi là gỉ sét. Đây là một ví dụ điển hình về phản ứng oxy hóa . Các ví dụ hàng ngày khác bao gồm sự hình thành của verdigris hay còn gọi là gỉ đồng (là chất xanh lục tạo thành trên các bề mặt của đồng cỏ, đồng thau và đồng thiếc (như) là những dạng gỉ trên bề mặt) trên bề mặt các thanh đồng và sự xỉn màu của bạc.
Rỉ sét (hay gỉ sét) là sắt bị oxy hóa. Rỉ sét được hình thành do sắt kết hợp với oxy khi có mặt nước hoặc không khí ẩm. Trên bề mặt sắt thép bị rỉ hình thành những lớp vảy rất dễ vỡ, thường có màu nâu, nâu đỏ hoặc đỏ. Lớp rỉ này không có tác dụng bảo vệ sắt ở phía trong. Nếu có đủ thời gian, oxy và nước, bất kỳ khối sắt nào cũng sẽ bị rỉ hoàn toàn và phân hủy.
Nguyên nhân hiện tượng gỉ sát do sắt hay hợp kim của sắt (như thép…) tiếp xúc với oxy và độ ẩm trong một khoảng thời gian dài, tạo thành một hợp chất mới gọi là oxít sắt hay còn gọi là rỉ sắt. Chất xúc tác chính cho quá trình rỉ là nước. Cấu trúc sắt hoặc thép có vẻ chắc chắn, nhưng các phân tử nước có thể xâm nhập vào các lỗ nhỏ và vết nứt trong bất kỳ kim loại nào kể cả sắt, sự kết hợp của nguyên tử hidro có trong nước với các nguyên tố khác để hình thành axít, ăn mòn sắt, làm cho sắt bị phơi ra nhiều hơn. Nếu trong môi trường nước biển, sự ăn mòn có thể xảy ra nhanh hơn. Trong khi đó các nguyên tử oxy kết hợp với các nguyên tử sắt để hình thành oxít sắt hay rỉ sắt, chúng làm yếu sắt và làm cho cấu trúc của sắt trở nên giòn và xốp. Do đó hiện tượng gỉ sét sẽ làm gia tăng và đẩy nhanh quá trình ăn mòn, do đó việc bảo dưỡng là điều quan trọng.
Dưới đây là phương trình hóa học mô tả quá trình rỉ sét của sắt: Fe + O2 + H2O → Fe2O3 . XH2O

Gỉ sét 
Gỉ sét -
Kết hợp các hóa chất
Trên thực tế có rất nhiều hóa chất kết hợp với nhau. Các phản ứng hóa học này rất dễ làm nhưng lại có nhiều ứng dụng trong gia đình, đời sống. Nếu bạn kết hợp giấm và baking soda để tạo ra một ngọn núi lửa nhân tạo hoặc sữa với bột nở trong công thức nấu ăn, bạn sẽ có những sản phẩm với kích thước gấp đôi, hoặc sẽ tạo ra các phản ứng hoán vị (khi cộng thêm một số thứ khác). Các thành phần kết hợp lại để tạo ra khí carbon dioxide và nước. Carbon dioxide tạo thành bong bóng trong núi lửa và giúp chiếc bánh nướng phồng to lên.
Những phản ứng hóa học trong đời sống kiểu hoán vị này có vẻ đơn giản nhưng nó lại mang lại nhiều tác dụng bất ngờ. Chẳng hạn khi baking soda tác dụng với giấm nó sẽ mang lại nhiều công dụng bất ngờ đấy, baking soda là loại muối nở có chứa các thành phẩn tẩy rửa có thể làm sạch các vệt ố, dơ bẩn trên các đồ vật, giâm là một chất có tính axit mạnh, đây cũng là chất axit có tính tẩy rửa hiệu quả nếu như bạn áp dụng chúng lên các đồ vật, khi hai hỗn hợp này kết hợp lại với nhau sẽ tạo ra phải ứng có ga ( sủi bọt khí ) giúp đánh tan các vết bẩn.
Phản ứng này rất có lợi cho việc làm sạch các chất thải làm cho các liên kết bị đánh tan ra chứ không còn bám chặt như lúc ban đầu vì vậy mà bạn có thể dễ dàng áp dụng chúng để làm sạch các vết bẩn trên đồ vật của mình, ngoài việc sử dụng phản ứng hóa học cho mục đích làm sạch, bạn cũng có thể sử dụng baking soda và giấm riêng để làm sạch cùng một vật phẩm.Dưới đây là phương trình hóa học tổng thể cho phản ứng giữa baking soda và giấm:HC2H3O2 (aq) + NaHCO3 (aq) → NaC2H3O2 (aq) + H2O + CO2 (g)

Kết hợp các hóa chất 
Kết hợp các hóa chất -
Pin
Trong cuộc sống hằng ngày có rất nhiều đồ vật chúng ta phải sử dụng đến Pin. Như quạt, đồng hồ hay đồ chơi trẻ con... Pin còn được viết theo tiếng Anh là "battery" biến đổi năng lượng hóa học thành năng lượng điện.Từ khi được sáng chế lần đầu vào năm 1800 bởi Alessandro Volta, đến nay pin đã trở thành nguồn năng lượng thông dụng cho nhiều đồ vật trong gia đình cũng như cho các ứng dụng công nghiệp.
Pin sử dụng phản ứng điện – hóa học hay phản ứng oxi hóa khử để biến đổi năng lượng hóa học thành điện năng. Phản ứng oxi hóa tự nhiên này xảy ra trong các tế bào điện, còn phản ứng hóa học nhân tạo xảy ra ở trong các bình điện phân.Về cơ bản pin có những thành phần và đặc điểm giống ắcquy nhưng có rất nhiều điểm khác pin thông thường là thiết bị tồn trữ năng lượng và sẽ ngừng hoạt động khi các chất hóa học được tiêu thụ hết cần phải nạp điện lại từ nguồn cung cấp điện bên ngoài, ngược lại pin nhiên liệu thì không tích trữ nhiên liệu bên trong, dòng điện trong pin được tạo ra liên tục khi có nguồn nhiên liệu bên ngoài được cung cấp trực tiếp và liên tục. So với các loại pin cổ điển, pin nhiên liệu sinh ra chất thải gây ô nhiễm môi trường rất thấp hoặc không gây ô nhiễm và lượng nước sinh ra sau phản ứng là nước sạch có thể dùng uống được.

Pin 
Pin -
Tiêu hóa
Quá trình tiêu hóa là hoạt động không thể thiếu diễn ra hàng ngày trong cơ thể của tất cả các loài động vật, nhưng trên thực tế thì không phải ai cũng hiểu về khái niệm tiêu hóa đặc biệt là quá trình tiêu hóa diễn ra như thế nào. Tiêu hóa là quá trình biến đổi các chất hữu cơ phức tạp thành các chất dinh dưỡng đơn giản mà cơ thể có thể hấp thụ được. Tiêu hóa bao gồm quá trình biến đổi về cơ học và hóa học các loại thức ăn diễn ra ở nhiều cơ quan bộ phận khác nhau trong tế bào và cơ thể. Cuối cùng được cơ thể hấp thu và chất thải được loại ra ngoài.
Hàng ngàn quá trình tiêu hóa diễn ra khi chúng ta ăn uống. Ngay khi bạn cho thức ăn vào miệng, một loại enzyme trong nước bọt có tên là amylase sẽ bắt đầu phân hủy đường và carbohydrate thành các dạng đơn giản hơn mà cơ thể có thể hấp thu. Sau đó, khi thức ăn xuống dạ dày, axit hydrochloric trong dạ dày của bạn sẽ phản ứng với thức ăn để tiếp tục cắt nhỏ nó, đồng thời, các enzyme sẽ cắt protein và chất béo để chúng có thể được hấp thụ vào máu của bạn thông qua các tế bào thành ruột.
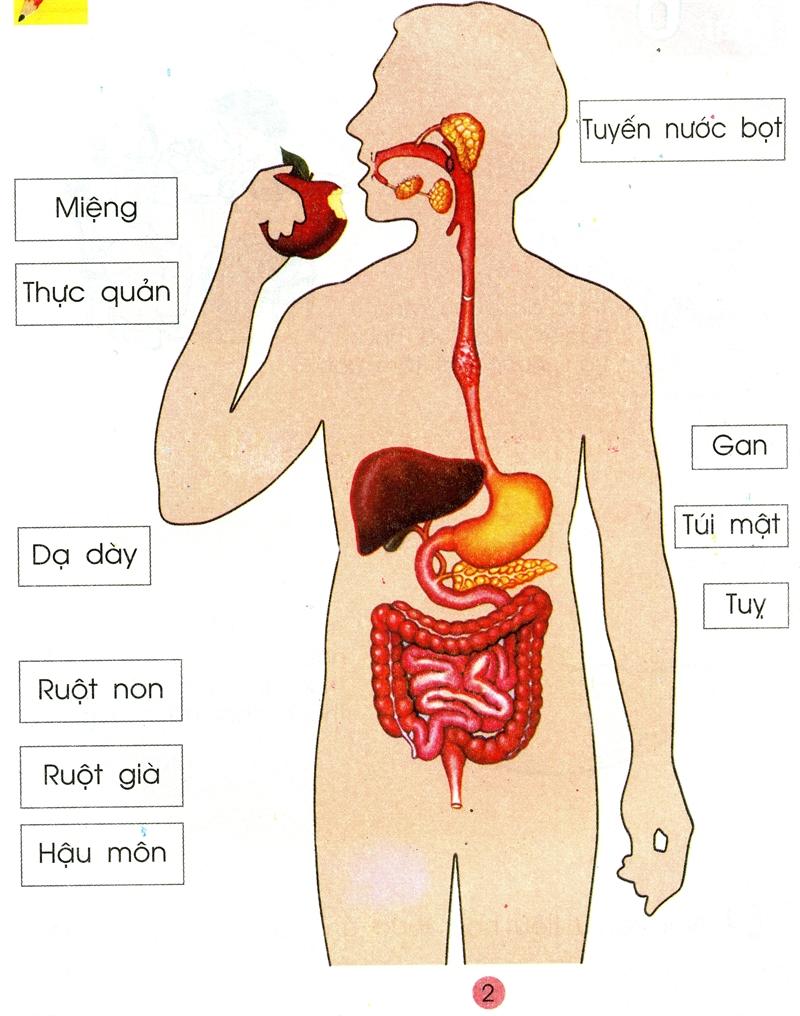
Tiêu hóa 
Tiêu hóa -
Phản ứng axit - bazo
Axit là những chất có chứa một hoặc nhiều nguyên tử hydro , trong dung dịch , được giải phóng dưới dạng các ion hydro mang điện tích dương . Một axit trong dung dịch nước có vị chua, làm đổi màu giấy quỳ xanh thành đỏ, phản ứng với một số kim loại (ví dụ sắt ) để giải phóng hydro, phản ứng với bazơ tạo thành muối và thúc đẩy một số phản ứng hóa học (xúc tác axit). Bazơ là những chất có vị đắng và làm đổi màu giấy quỳ đỏ thành xanh. Bazơ phản ứng với axit tạo thành muối và thúc đẩy các phản ứng hóa học nhất định (xúc tác bazơ).
Khi ta kết hợp một loại axit (như giấm, chanh) với một bazo (như baking soda, xà phòng), thì ta đang thực hiện một phản ứng axit - bazo. Đây là những phản ứng trung hòa, tạo ra muối và nước.
Ví dụ về phương trình hóa học tổng
quát của phản ứng axit-bazo tạo ra kali clorua: HCl + KOH → KCl + H2O.
Phản ứng axit - bazo 
Phản ứng axit - bazo -
Phản ứng của xà phòng, các chất tẩy rửa
Từ xa xưa, con người đã biết sử dụng các chất có khả năng tẩy rửa từ thiên nhiên như: Tro, trấu, bồ kết, quả bồ hòn, chanh, muối,… để vệ sinh đồ vật. Ngày nay, với sự phát triển của công nghệ, các nhà khoa học đã điều chế ra nhiều loại hóa chất tẩy rửa phục vụ đời sống con người như xà phòng và các chất tẩy rửa.
Xà phòng hay xà bông là một chất tẩy rửa các vết bẩn, vết dầu mỡ, diệt vi khuẩn. Thành phần của xà phòng là muối natri hoặc kali của axít béo. Xà phòng được dùng dưới dạng bánh, bột hoặc chất lỏng. Xà phòng trước kia được điều chế bằng cách cho chất béo tác dụng với kiềm bằng phản ứng xà phòng hoá. Sản phẩm tạo ra là muối natri hoặc kali của axit béo. Vì thế xà phòng được phân loại thành xà phòng cứng (chứa natri) và xà phòng mềm (chứa kali). Loại xà phòng này có một nhược điểm là không giặt được trong nước cứng vì nó tạo các kết tủa với các ion calci và magiê bết lên mặt vải làm vải chóng mục. mà chúng ta sử dụng hàng ngày giúp làm sạch chính là các phản ứng hóa học.
Xà phòng có thể làm sạch bụi bẩn, rồi theo nước rửa mà trôi đi. Chất tẩy rửa hoạt động theo cơ chế chất hoạt tính bề mặt, làm giảm sức căng bề mặt của nước để nước có thể tương tác với dầu, khắc chế, và rửa trôi bụi bẩn, vi khuẩn.

Phản ứng của xà phòng, các chất tẩy rửa 
Phản ứng của xà phòng, các chất tẩy rửa